Tijdens de eerste en tweede ronde kunnen volgende hulpmiddelen worden gebruikt bij chemie: het periodiek systeem en volgende nuttige gegevens.
Tekst in oranje: enkel voor de deelnemers aan de 2de ronde
Classificatie en eigenschappen van stoffen
- Zuivere stoffen en mengsels
- Soorten mengsels:
- verschillende soorten homogene en heterogene mengsels
- Verschillende soorten scheidingstechnieken (zeven, filtreren, decanteren, indampen, destilleren, adsorptie, extractie, chromatografie en centrifugeren) gebaseerd op stofeigenschappen (deeltjesgrootte, massadichtheid, kook- en smeltpunt, oplosgedrag van stoffen)
- Enkelvoudige stoffen (metalen, niet-metalen en edelgassen): symbolische voorstelling, algemene eigenschappen en naamgeving
- Samengestelde stoffen:
- onderscheid organische en anorganische stof
- symbolische voorstelling, algemene eigenschappen en naamgeving van de anorganische stofklassen (oxiden, hydroxiden, (binaire en ternaire) zuren en zouten) en de organische stofklassen: (onvertakte) alkanen, alkenen, alcoholen en carbonzuren
Corpusculaire structuren
- molecule, atoom, ion, element: onderscheid en symbolische voorstelling (index en coëfficiënt)
- atoommodellen tot en met Bohr
- elektronenconfiguraties voor atomen met Z≤18 volgens het model van Bohr
- molecuul-, atoom-, metaal- en ionroosters
Het periodiek systeem van de chemische elementen
- hoofdgroepen (namen en betekenis), perioden (betekenis), plaats van de metalen, niet-metalen en de edelgassen
- elektronegatieve waarde (EN)
- oxidatiegetal (OG) afleiden van het PSE & bepalen in verbindingen
- betekenis van een voorstelling als
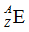
- Atoommassaeenheid (amu), absolute atoommassa
- relatieve atoommassa en relatieve molecuulmassa, relatieve ionmassa en relatieve formulemassa, molaire massa
- Isotopen; berekenen procentueel voorkomen van een nuclide in een isotopenmengsel; berekenen relatieve atoommassa vertrekkende van gegeven isotopenmengsel
Chemische reactie
- onderscheid chemisch en fysisch proces
- inerte stoffen
- wet van Lavoisier
- endo- en exo-energetische chemische reacties; interpreteren van energiediagrammen
- corpusculaire en symbolische voorstelling (reactievergelijking)
- Opstellen en balanceren van eenvoudige reacties:
- Verbrandings-, neutralisatie-, neerslag-, gasontwikkelings- en redoxreacties
- Analysereacties, elektrolyse, thermolyse, fotolyse
- Synthesereacties
- Eenvoudige stoichiometrische vraagstukken
- Redoxreacties:
- Reductie, oxidatie, reductor, oxidator
- Redoxreactie met 1 reductor en 1 oxidator
Chemische binding
- ionbinding, atoombinding (covalente binding) en metaalbinding
- algemene eigenschappen van ionverbindingen, covalente verbindingen (molecuulverbindingen) en metalen
- Lewisstructuur opstellen van binaire stoffen
Gedrag van stoffen in water
- polaire en apolaire stoffen en oplosmiddelen
- massaconcentratie en molaire concentratie van een waterige oplossing
- waterige oplossingen en verdunningen
- Intermoleculaire krachten: H-bruggen, dipoolkrachten, london-dispersiekrachten
- Oplosproces van stoffen in water: elektrolyt, niet-elektrolyt, dissociatie en ionisatie
- Verband tussen pH en concentratie van hydroxoniumionen
- Verband tussen pH en concentratie van hydroxideionen
- Zuur base indicatoren
Stofkennis van volgende enkelvoudige en samengestelde stoffen
- diwaterstof, dizuurstof, trizuurstof, dichloor, dijood, diamant, grafiet, octazwavel
- natrium, ijzer, lood, kwik, koper, aluminium,
- natriumchloride, natriumwaterstofcarbonaat, calciumcarbonaat
- waterstofchloride, (di)waterstofsulfaat (zwavelzuur)
- ammoniak, natriumhydroxide, calcium(di)hydroxide
- koolstofdioxide, koolstofoxide








